Строение алканов гомологический ряд номенклатура и изомерия. Международная номенклатура алканов
Цель: знакомство учащихся с особенностями строения, гомологическим рядом, изомерией, номенклатурой алканов, их получением.
- Образовательные. Получить первоначальные представления о алканах (общая формула, гомологический ряд алканов, их состав и строение, применение).
- Развивающие. Развивать полученные раннее представления об изомерии и умения давать названия по номенклатуре ИЮПАК.
- Воспитательные. Воспитывать желание учится активно, с интересом, повышать мотивацию к изучению химии.
Оборудование: компьютер, мультимедиа проектор, экран.
Ход работа
I. Организационный момент.
II. Мотивационный блок.
Учитель. Мы продолжаем изучать органическую химию. Я предлагаю перенестись вам на 160 лет назад, в добрую старую Англию (Презентация . Слайд 1 ) .
1848г в Ньюкастле умерла 15-летняя Ханна Гринер во время небольшого хирургического вмешательства. Врач Меггисон, который проводил операцию, во время дознания так изложил факты. “Я усадил больную в кресло и поднес к ее носу платок, смоченный всего одной чайной ложечкой этого вещества. Ханна сделала два вдоха. Через минуту я попросил моего ассистента приступить к операции. Еще через минуту, я приоткрыл ей глаза, они так и остались открытыми, сосуды склер были переполнены кровью, губы, и лицо сильно побелели. Я решил выполнить кровопускание из вен, но получил крови не больше ложки. Я думаю, что до моей попытки кровопускания она была мертва. С момента первого вдыхания этого вещества и до смерти прошло не более трех минут”. Что стало причиной смерти Ханны до сих пор загадка. Как вы думаете, о каком веществе идет речь? (Выслушиваются все предположения.) Хлороформ. Найдите формулу. (Используют справочник, интернет.) СН3Сl. Это вещество является производным СН4. К какому классу относится это вещество? Алканы. (Учащиеся записывают тему урокав тетрадь). Алканы, первый класс из всех классов органических веществ которые мы будем изучать. Поэтому я предлагаю вам план по которому будут изучаться все классы органических веществ.
1. Определение. Формула. Состав.
2. Строение.
3. Гомологический ряд. Номенклатура.
4. Виды изомерии.
5. Способы получения.
6. Физические свойства.
7. Химические свойства.
8. Применение.
(Пункты 1–5 изучаются на первом уроке, 6–8 на втором уроке.)
III. Целепологание.
Посмотрите первые 5 пунктов плана и сформулируйте цель урока.
IV. Исполнительский блок.
Учитель: Как вы думаете, ребята, а зачем нам изучать алканы? Откройте учебник стр.79. рассмотрите схему применения алканов. Как вы видите, алканы имеют широкое применение. Поэтому, я думаю, что каждый человек должен знать о строении, свойствах и получении этих веществ.
Учитель. Что вы знаете об алканах? (На доске записываются все ответы учащихся. Общая формула CnH2n+2; С-С одинарная связь, -ан) На основании записей, учащиеся дают общую характеристику алканам. Сверяются с слайдом (Слайд 2).
Среди формул органических веществ, выбрать формулы алканов (работа с тренажером) (Приложение 1) . Все формулы найденные учащимися, учитель записывает на доске в столбик. Образуется ряд веществ, которые отличаются друг от друга на одну или несколько групп СН2. Учащиеся делают вывод, что образовался гомологический ряд (Слайд 3) .
Вспоминают номенклатуру алканов.
Учитель. Строение алканов изучаем на примере молекулы метана. Просмотрев фрагмент ответьте на вопросы: – Что такое гибридизация ? – Какой тип гибридизации у алканов? – Углы между орбиталями? Длина С-Ссвязи? (просмотр Cтроение молекулы метана (N 132051) ЦОР) . (Работа со Слайдом 4 ).
Учитель. Давайте вспомним, что такое изомерия, и какие виды изомерии характерны для органических веществ (Сслайд 5) .
Как вы думаете, какие виды изомерии характерны для апканов? Методом исключения учащиеся устанавливают, что для алканов характерен один вид изомерии. Изомерия углеродного скелета. Один из учащихся выходит к доске строит изомеры для вещества с формулой С5Н12, даёт им названия, используя номенклатуру ИЮПАК (получает оценку) . По желанию, к доске приглашается учащийся для выполнения обратного задания.
Задание. Составьте структурные формулы, для следующих веществ.
а) 2,3 диметилпентана; б) 2,5 диметилгексана; г) 3 метил-3 этилгептана (получает оценку).
Учитель. Так, как алканы имеют широкое применение, необходимо изучить способы их получения. (Получение изучается с помощью учебника стр.70. Реакции записываются в тетрадь со Слайда 6)
V. Контрольно-оценочный блок.
Предлагается самостоятельная работа в виде теста (Приложение 2) . (Идет взаимопроверка, выставляются оценки). Вернутся к плану урока, посмотреть 1–5 пунктов, ответить на вопросы
– Достигли ли мы поставленной цели?
– Что нового на уроке узнали?
– Что было интересным?
Изомерия
Способность атомов углерода к образованию четырех ковалентных связей, в том числе и с другими атомами углерода, открывает возможность существования нескольких соединений одного элементного состава -- изомеров.
Все изомеры делят на два больших класса -- структурные изомеры и пространственные изомеры. Структурными называют изомеры, отвечающие различным структурным формулам органических соединений (с разным порядком соединения атомов). Пространственные изомеры имеют одинаковые заместители у каждого атома углерода и отличаются лишь их взаимным расположением в пространстве. Структурные изомеры. В соответствии с приведенной выше классификацией органических соединений по типам среди структурных изомеров выделяют три группы:
1) соединения, содержащие различные функциональные группы и относящиеся к различным классам органических соединений, например:
CH3-CH2-NO2 HOOC-CH2-NH2
нитроэтан амииоуксусная кислота (глицин)
2) соединения, отличающиеся углеродными скелетами:
бутан 2-метнлпропан (изобутан)
3) соединения, отличающиеся положением заместителя или кратной связи в молекуле:
СН3-СН=СН-СН3 СН3-СН2-СН=СН2
бутен-2 бутен-1
пропанол-2 пропанол-1
Пространственные изомеры (стереоизомеры). Стереоизомеры можно разделить на два типа: геометрические изомеры оптические изомеры.
Геометрическая изомерия характерна для соединений, содержащих двойную связь или цикл. В таких молекулах часто возможно провести условную плоскость таким образом, что заместители у различных атомов углерода могут оказаться по одну сторону (цис-) или по разные стороны (транс-) от этой плоскости.
Если изменение ориентации этих заместителей относительно плоскости возможно только за счет разрыва одной из химических связей, то говорят о наличии геометрических изомеров. Геометрические изомеры отличаются своими физическими и химическими свойствами.
транс -1,2- цис-1,2- цис-бутен-2 транс-6утен-2
диметил- диметил-
циклопентан циклопентан
Оптическими изомерами называют молекулы, зеркальные изображения которых не совместимы друг с другом.
Таким свойством обладают молекулы, имеющие асимметрический центр -- атом углерода, связанный с четырьмя различными заместителями. Например, в виде двух оптических изомеров существует молекула молочной кислоты СН 3-СН(ОН)- СООН, содержащая один асимметрический центр:
Алканы. Общая характеристика
Углеводороды - простейшие органические соединения, состоящие из двух элементов: углерода и водорода. Предельными углеводородами, или алканами (международное название), называются соединения, состав которых выражается общей формулой С n Н2n+2, где n - число атомов углерода. В молекулах предельных углеводородов атомы углерода связаны между собой простой (одинарной) связью, а все остальные валентности насыщены атомами водорода. Алканы называют также насыщенными углеводородами или парафинами (Термин «парафины» означает «имеющие малое сродство»).
Первым членом гомологического ряда алканов является метан СН4. Окончание -ан является характерным для названий предельных углеводородов. Далее следует этан С2Н6, пропан С3Н8, бутан С4Н10. Начиная с пятого углеводорода, название образуется из греческого числительного, указывающего число углеродных атомов в молекуле, и окончания -ан. Это пентан С5Н12 гексан С6Н14, гептан С7Н16, октан С8Н18, нонан С9Н20, декан С10Н22 и т. д.
В гомологическом ряду наблюдается постепенное изменение физических свойств углеводородов: повышаются температуры кипения и плавления, возрастает плотность. При обычных условиях (температура ~ 22°С) первые четыре члена ряда (метан, этан, пропан, бутан) -- газы, с С5Н12 до С16Н34 - жидкости, а с С17Н36 -- твердые вещества.
Алканы, начиная с четвертого члена ряда (бутана), имеют изомеры.
Все алканы насыщены водородом до предела (максимально). Их атомы углерода находятся в состоянии sp 3 --гибридизации, а значит, имеют простые (одинарные) связи.
Номенклатура:
Названия первых десяти членов ряда предельных углеводородов уже даны. Чтобы подчеркнуть, что алкан имеет неразветвленную углеродную цепь, часто к названию добавляют слово нормальный (н-), например:
СН3--СН2--СН2--СН3 СН3--СН2--СН2--СН2--СН2--СH 2 --СН3
н-бутан н-гептан
(нормальный бутан) (нормальный гептан)
При отрыве атома водорода от молекулы алкана образуются одновалетные частицы, называемые углеводородными радикалами (сокращенно обозначаются буквой R). Названия одновалентных радикалов производятся от названий соответствующих углеводородов с заменой окончания -ан на -ил. Вот соответствующие примеры:
Углеводороды
Гексан C 6 H 14
Этан C 2 H 6
Гептан C 7 H 16
Пропан C 3 H 8
Октан C 8 H 18
Бутан C 4 H 10
Нонан C 9 H 20
Пентан C 5 H 12
Декан C 10 H 22
Одновалентные радикалы
Метил CH 3 -
Гексил C 6 H 13 -
Этил C 2 H 5 -
Гептил C 7 H 15 -
Пропил C 3 H 7 -
Октил C 8 H 17 -
Бутил C 4 H 9 -
Нонил C 9 H 19 -
Пентил (амил) C 5 H 11 -
Децил C 10 H 21 -
Радикалы образуются не только органическими, но и неорганическими соединениями. Так, если от азотной кислоты отнять гидроксильную группу ОН, то получится одновалентный радикал -- NO2 , называемый нитрогруппой, и т. д.
При отнятии от молекулы углеводорода двух атомов водорода получаются двухвалентные радикалы. Их названия также производятся от названий соответствующих предельных углеводородов с заменой окончания -ан на -илиден (если атомы водорода оторваны от одного атома углерода) или -илен (если атомы водорода оторваны от двух соседних атомов углерода). Радикал СН2= имеет название метилен.
Названия радикалов используются в номенклатуре многих производных углеводородов. Например: СН3I - йодистый метил, С4Н9Сl -хлористый бутил, СН 2Сl 2 - хлористый метилен, С2Н4Вr 2 - бромистый этилен (если атомы брома связаны с разными атомами углерода) или бромистый этилиден (если атомы брома связаны с одним атомом углерода).
Для названия изомеров широко применяют две номенклатуры: старую - рациональную и современную - заместительную, которую также называют систематической или международной (предложена Международным союзом теоретической и прикладной химии ИЮПАК).
По рациональной номенклатуре углеводороды рассматриваются как производные метана, у которого один или несколько атомов водорода замещены на радикалы. Если в формуле одинаковые радикалы повторяются несколько раз, то их указывают греческими числительными: ди - два, три - три, тетра - четыре, пента - пять, гекса - шесть и т. д. Например:

Рациональная номенклатура удобна для не очень сложных соединений.
По заместительной номенклатуре основой для названия служит одна углеродная цепь, а все другие фрагменты молекулы рассматриваются как заместители. В этом случае выбирают наиболее длинную цепь углеродных атомов и атомы цепи нумеруют с того конца, к которому ближе стоит углеводородный радикал. Затем называют: 1) номер углеродного атома, с которым связан радикал (начиная с простейшего радикала); 2) углеводород, которому соответствует длинная цепь. Если в формуле содержится несколько одинаковых радикалов, то перед их названием указывают число прописью (ди-, три-, тетра- и т. д.), а номера радикалов разделяют запятыми. Вот как по этой номенклатуре следует назвать изомеры гексана:

Как заместительная, так и рациональная номенклатура применяются не только для углеводородов, но и для других классов органических соединений. Для некоторых органических соединений используются исторически сложившиеся (эмпирические) или так называемые тривиальные названия (муравьиная кислота, серный эфир, мочевина и др.).
При написании формул изомеров легко заметить, что атомы углерода занимают в них неодинаковое положение. Атом углерода, который связан только с одним атомом углерода в цепи, называется первичным, с двумя - вторичным, с тремя - третичным, с четырьмя - четвертичным. Так, например, в последнем примере атомы углерода 1 и 7 - первичные, 4 и 6 - вторичные, 2 и 3 - третичные, 5 - четвертичный. Свойства атомов водорода, других атомов и функциональных групп зависят от того, с каким углеродным атомом они связаны: с первичным, вторичным или третичным. Это всегда надо учитывать.
Строение алканов
Алканы - углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле C n H 2n+2 . В молекулах алканов все атомы углерода находятся в состоянии sр 3 -гибридизации .
Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в углы равносторонней треугольной пирамиды - тетраэдра . Углы между орбиталями равны 109° 28′. Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение, и молекулы алканов могут приобретать самую разнообразную форму с углами при атомах углерода, близкими к тетраэдрическому (109° 28′), например, в молекуле н-пентан.

Особо стоит напомнить о связях в молекулах алканов. Все связи в молекулах предельных углеводородов одинарные. Перекрывание происходит по оси, соединяющей ядра атомов, т. е. это σ-связи . Связи углерод - углерод являются неполярными и плохо поляризуемыми. Длина С-С связи в алканах равна 0,154 нм (1,54 10 10 м). Связи С-Н несколько короче. Электронная плотность немного смещена в сторону более электроотрицательного атома углерода, т. е. связь С-Н является слабополярной .
Гомологический ряд метана
Гомологи - вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СН 2 .


Предельные углеводороды составляют гомологический ряд метана.
Изомерия и номенклатура алканов
Для алканов характерна так называемая структурная изомерия . Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкан, для которого характерны структурные изомеры, - это бутан.
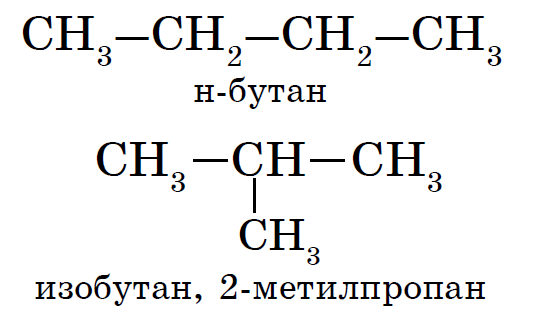
Рассмотрим подробнее для алканов основы номенклатуры ИЮПАК .
1. Выбор главной цепи . Формирование названия углеводорода начинается с определения главной цепи - самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2. Нумерация атомов главной цепи . Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (-СН 3), затем пропил (-СН 2 -СН 2 -СН 3), этил (-СН 2 -СН 3) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.
3. Формирование названия . В начале названия указывают цифры - номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2-). После номера через дефис указывают количество заместителей (ди - два, три - три, тетра - четыре, пента - пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов - название главной цепи. Главная цепь называется как углеводород - член гомологического ряда метана (метан, этан, пропан и т. д.).




Названия веществ, структурные формулы которых приведены выше, следующие:
Структура А: 2-метилпропан;
Структура Б: 3-этилгексан;
Структура В: 2,2,4-триметилпентан;
Структура Г: 2-метил 4-этилгексан.
Отсутствие в молекулах предельных углеводородов полярных связей приводит к тому, что они плохо растворяются в воде , не вступают во взаимодействие с заряженными частицами (ионами) . Наиболее характерными для алканов являются реакции, протекающие с участием свободных радикалов .
Физические свойства алканов
Первые четыре представителя гомологического ряда метана - газы . Простейший из них - метан - газ без цвета, вкуса и запаха (запах «газа», почувствовав который, надо звонить 04, определяется запахом меркаптанов - серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от С 5 Н 12 до С 15 Н 32 - жидкости; более тяжелые углеводороды - твердые вещества. Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.


Химические свойства алканов
Реакции замещения.
Наиболее характерными для алканов являются реакции свободнорадикального замещения , в ходе которого атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения характерных реакций галогенирования :
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор :

Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
Реакция дегидрирования (отщепления водорода).
В ходе пропускания алканов над катализатором (Pt, Ni, Al 2 O 3 , Cr 2 O 3) при высокой температуре (400-600 °C) происходит отщепление молекулы водорода и образование алкена :
Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться.
1. Горение предельных углеводородов - это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
В общем виде реакцию горения алканов можно записать следующим образом:
2. Термическое расщепление углеводородов .
Процесс протекает по свободнорадикальному механизму . Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов.
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена :
Реакции термического расщепления лежат в основе промышленного процесса - крекинга углеводородов . Этот процесс является важнейшей стадией переработки нефти.
3. Пиролиз . При нагревании метана до температуры 1000 °С начинается пиролиз метана - разложение на простые вещества:
При нагревании до температуры 1500 °С возможно образование ацетилена :
4. Изомеризация . При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом :

5. Ароматизация . Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:

Алканы вступают в реакции, протекающие по свободнорадикальному механизму, т. к. все атомы углерода в молекулах алканов находятся в состоянии sp 3 -гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С-С (углерод - углерод) связей и слабополярных С-Н (углерод - водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т. е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т. к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Алканы: состав, строение, изомерия, номенклатура, получение
Учитель химии МБОУ СОШ № 80 г. Краснодар,
Празян Валентина Григорьевна
Цель: знакомство учащихся с особенностями строения, гомологическим рядом, изомерией, номенклатурой алканов, их получением.
Задачи:
Образовательные. Получить первоначальные представления о алканах (общая формула, гомологический ряд алканов, их состав и строение, применение).
Развивающие. Развивать полученные раннее представления об изомерии и умения давать названия по номенклатуре ИЮПАК.
Воспитательные. Воспитывать желание учится активно, с интересом, повышать мотивацию к изучению химии.
Оборудование: компьютер, мультимедиа проектор, экран.
Ход работа
I. Организационный момент.
II. Мотивационный блок.
Учитель. Мы продолжаем изучать органическую химию. Я предлагаю перенестись вам на 160 лет назад, в добрую старую Англию ( . Слайд 1 ) .
1848г в Ньюкастле умерла 15-летняя Ханна Гринер во время небольшого хирургического вмешательства. Врач Меггисон, который проводил операцию, во время дознания так изложил факты. “Я усадил больную в кресло и поднес к ее носу платок, смоченный всего одной чайной ложечкой этого вещества. Ханна сделала два вдоха. Через минуту я попросил моего ассистента приступить к операции. Еще через минуту, я приоткрыл ей глаза, они так и остались открытыми, сосуды склер были переполнены кровью, губы, и лицо сильно побелели. Я решил выполнить кровопускание из вен, но получил крови не больше ложки. Я думаю, что до моей попытки кровопускания она была мертва. С момента первого вдыхания этого вещества и до смерти прошло не более трех минут”. Что стало причиной смерти Ханны до сих пор загадка. Как вы думаете, о каком веществе идет речь? (Выслушиваются все предположения.) Хлороформ. Найдите формулу. (Используют справочник, интернет.) СН3Сl. Это вещество является производным СН4. К какому классу относится это вещество? Алканы. ( Учащиеся записывают тему урока в тетрадь). Алканы, первый класс из всех классов органических веществ которые мы будем изучать. Поэтому я предлагаю вам план по которому будут изучаться все классы органических веществ.
План.
1. Определение. Формула. Состав.
2. Строение.
3. Гомологический ряд. Номенклатура.
4. Виды изомерии.
5. Способы получения.
6. Физические свойства.
7. Химические свойства.
8. Применение.
(Пункты 1–5 изучаются на первом уроке, 6–8 на втором уроке.)
III. Целепологание.
Посмотрите первые 5 пунктов плана и сформулируйте цель урока.
IV. Исполнительский блок.
Учитель: Как вы думаете, ребята, а зачем нам изучать алканы? Откройте учебник стр.79. рассмотрите схему применения алканов. Как вы видите, алканы имеют широкое применение. Поэтому, я думаю, что каждый человек должен знать о строении, свойствах и получении этих веществ.
Учитель. Что вы знаете об алканах? (На доске записываются все ответы учащихся. Общая формула CnH2n+2; С-С одинарная связь, -ан) На основании записей, учащиеся дают общую характеристику алканам. Сверяются с слайдом (Слайд 2).
Среди формул органических веществ, выбрать формулы алканов (работа с тренажером) . Все формулы найденные учащимися, учитель записывает на доске в столбик. Образуется ряд веществ, которые отличаются друг от друга на одну или несколько групп СН2. Учащиеся делают вывод, что образовался гомологический ряд (Слайд 3) .
Вспоминают номенклатуру алканов.
Учитель. Строение алканов изучаем на примере молекулы метана . Просмотрев фрагмент ответьте на вопросы: – Что такое гибридизация ? – Какой тип гибридизации у алканов? – Углы между орбиталями? Длина С-Ссвязи? ( просмотр Cтроение молекулы метана (N 132051) ЦОР) . (Работа со Слайдом 4 ).
Учитель. Давайте вспомним, что такое изомерия, и какие виды изомерии характерны для органических веществ (Сслайд 5) .
Как вы думаете, какие виды изомерии характерны для апканов? Методом исключения учащиеся устанавливают, что для алканов характерен один вид изомерии. Изомерия углеродного скелета. Один из учащихся выходит к доске строит изомеры для вещества с формулой С5Н12, даёт им названия, используя номенклатуру ИЮПАК (получает оценку) . По желанию, к доске приглашается учащийся для выполнения обратного задания.
Задание. Составьте структурные формулы, для следующих веществ.
а) 2,3 диметилпентана; б) 2,5 диметилгексана; г) 3 метил-3 этилгептана (получает оценку).
Учитель. Так, как алканы имеют широкое применение, необходимо изучить способы их получения . (Получение изучается с помощью учебника стр.70. Реакции записываются в тетрадь со Слайда 6)
V. Контрольно-оценочный блок.
Предлагается самостоятельная работа в виде теста. (Идет взаимопроверка, выставляются оценки). Вернутся к плану урока, посмотреть 1–5 пунктов, ответить на вопросы
– Достигли ли мы поставленной цели?
– Что нового на уроке узнали?
– Что было интересным?
VI. Домашнее задание. §11, стр 67–72, зад.2 (на дополнительную оценку зад.7,8).
Цель урока: создание условий для формирования знаний у учащихся об особенностях строения, гомологическом ряде, изомерии, номенклатуре алканов, способах их получения.
Задачи урока:
Образовательная : рассмотреть гомологический ряд предельных углеводородов, строение, физические свойства, способы их получения при переработке природного газа, возможности их получения из природных источников: природного и попутного нефтяного газов, нефти и каменного угля.
Развивающая : развитие познавательных интересов, творческих и интеллектуальных способностей, развитие самостоятельности в приобретении новых знаний с использованием новых технологий.
Воспитательная : показать единство материального мира на примере генетической связи углеводородов разных гомологических рядов, получаемых при переработки природного и попутного нефтяного газов, нефти и каменного угля.
Оборудование : шаростержневые модели, компьютер, мультимедиа проектор, экран, презентация.
Ход урока
Организационный момент.
Мотивационный блок.
Сообщение темы урока: "Алканы". (слайд 1)
Знакомства с планом изучения алканов.(слайд 3)
1. Определение. Формула. Состав. Строение. 2.Гомологический ряд. Номенклатура. 3.Виды изомерии.
4.Физические свойства. 5.Способы получения
6.Химические свойства.
7. Применение.
Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.) (слайд 4)
C n H 2n+2 (слайд 5)
Что такое гомологи? (учащиеся отвечают на данный вопрос)
Алканы, имея общую формулу С n H 2 n +2 , представляют собой ряд родственных соединений с однотипной структурой, в котором каждый последующий член отличается от предыдущего на постоянную группу атомов (-CH 2 -). Такая последовательность соединений называется гомологическим рядом (от греч. homolog – сходный), отдельные члены этого ряда – гомологами , а группа атомов, на которую различаются соседние гомологи, – гомологической разностью .
Задание 1. Из перечисленных углеводородов, выберите алканы и составьте гомологический ряд, начиная с наименьшего, запишите их молекулярные формулы:
Этан, Пропен, Бутан, Этилен, Метан, Ацетилен, Пропан, Бутен, Пропин, Гексан, Октен, Пентан, Бутен, Гептан, Декан. (слайд 6)
Гомологический ряд (ответ) (слайд7)
Название радикалов (слайд 8)
Строение алканов – метана и гомологов (слайд 9 – 10)
Каждое электронное облако обладает запасом энергии: s- облако имеет меньший запас энергии, чем р-облако, в атоме углерода они находятся в разных энергетических состояниях. Поэтому при образовании химической связи происходит гибридизация, т. е. выравнивание электронных облаков по запасу энергии. Это отображается на форме и направленности облаков, происходит перестройка (пространственная) электронных облаков.
В результате sp3 - гибридизации все четыре валентных электронных облака гибридизованы: валентный угол между этими осями гибридизованных облаков 109°28", поэтому молекулы имеют пространственную тетраэдрическую форму, форма углеродных цепей зигзагообразна; атомы углерода не находятся на одной прямой, т. к. при вращении атомов валентные углы остаются прежними.
Все органические вещества построены в основном за счёт ковалентных связей. Углерод - углеродные и углерод - водородные связи относятся к сигма - связям - это связь, образующаяся при перекрывании атомных орбиталей по линии, проходящей через ядра атомов. Возможно вращение вокруг сигма - связей, поскольку эта связь имеет осевую симметрию.
Виды изомерии для алканов: (слайд 11)
одинаковый состав (одинаковую молекулярную формулу), но разное
строение. Такие соединения называются изомерами .
Различия в порядке соединения атомов в молекулах (т. е. в химическом
строении) приводят к структурной изомерии . Строение структурных
изомеров отражается структурными формулами. В ряду алканов структурная изомерия проявляется при содержании в цепи 4-х и более атомов углерода, т. е. начиная с бутана С 4 Н 10 . (слайд 12)
Алгоритм составления названия алканов (слайд 13)
СН 3
а). СН 3 – СН 2 – С – СН 3 б). СН 3 – СН – СН – СН – СН 3
СН 3 СН 3 С 2 Н 5 СН 3
Задание 3. Составьте структурные формулы углеводородов по следующим названиям международной номенклатуры ИЮПАК: (слайд 15)
а). 2,3,3 –триметил-4-этилгексан
б). 2,3,4 – триметилгептан
Физические свойства. (слайд 16)
СН 4 -C 4 Н 10 - газы
T кипения: -161,6:-0,5 °C
T плавления: -182,5:-138,3 °C
С 5 Н 12 -C 15 Н 32 – жидкости
T кипения: 36,1:270,5 °C
T плавления: -129,8:10 °C
T кипения: 287,5 °C
T плавления: 20 °C
МЕТАН НА ЗЕМЛЕ(слайды 17)
МЕТАН - ПРОДУКТ ЖИЗНЕДЕЯТЕЛЬНОСТИ! (слайд 18)
ВКЛАД РАЗЛИЧНЫХ ФАКТОРОВ В ФОРМИРОВАНИЕ ОБЩЕГО ПОТОКА МЕТАНА В АТМОСФЕРУ ЗЕМЛИ(слайд 20-21)
ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ
Алканы выделяют из природных источников (природный и попутный газы, нефть, каменный уголь).
Используются также синтетические методы.
1. Крекинг нефти (промышленный способ)
C n H 2 n +2 C m H 2 m +2 + C n - m H 2(n - m)
алкан алкен
При крекинге алканы получаются вместе с непредельными соединениями
(алкенами). Этот способ важен тем, что при разрыве молекул высших алканов получается очень ценное сырье для органического синтеза: пропан, бутан, изобутан, изопентан и др.
2. Изомеризация алканов:
СН 3 –(СН 2) 6 -СН 3 СН 3 -C(CH 3) 2 –СН 2 –СН(CH 3)-СН 3
октан изооктан
2. Гидpиpование непpедельных углеводоpодов:
C n H 2 n C n H 2 n +2 C n H 2 n -2
алкены алканы алкины
3. Газификация твердого топлива (при повышенной температуре и давлении, катализатор Ni): С + 2Н 2 СН 4
4. Из синтез-газа (СО + Н 2) получают смесь алканов:
nCO + (2n+1)H 2 C n H 2 n +2 + nH 2 O
ЛАБОРАТОРНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ (слайд 26-35)
5. Синтез более сложных алканов из галогенопpоизводных с меньшим числом атомов углеpода:
2CH 3 Cl + 2Na CH 3 CH 3 + 2NaCl (синтез Вю p ца )
хлорметан этан
6. Из солей карбоновых кислот:
а) сплавление со щелочью (реакция Дюма )
CH 3 COONa + NaOH CH 4 + Na 2 CO 3
ацетат натрия
б) электролиз по Кольбе
электролиз
2RCOONa + 2H 2 O RR + 2CO 2 + H 2 + 2NaOH
на аноде на катоде
7. Разложение карбидов металлов (метанидов) водой:
Al 4 C 3 + 12H 2 O 4Al(OH) 3 + 3CH 4
Синтез алканов
Галогенопроизводные алканов широко применяются для синтеза алканов
с заданным строением молекул. Для этого используется реакция
взаимодействия их с активными металлами (реакция Вюрца):
C 2 H 5 I + 2Na + IC 2 H 5 C 4 H 10 + 2NaI
Если в реакции использовать разные галоидные алкилы, то получается смесь трех продуктов. Например:). CH 3 – CH – CH 3 б). CH 3 – CH 2
В). CH 2 – CH 2 г). СH 2 – CH 3
CH 3 CH 3 CH 2 – CH 3
3. Название углеводорода с формулой
CH 3 – CH 2 – CH 2 – CH – CH 3
а). 4-метилпентан б). 2-метилпропан
в). 3-метилпентан г). 2-метилпентан
4. Углеводороды с формулами C 6 H 12 и C 6 H 14 являются:
а) изомерами,
б) гомологами,
в) верного ответа в перечисленных нет.
5. Гидролизом карбида алюминия можно получить:
а). Этан б). Пропан в). Метан г). Этилен
IV. Домашнее задание:
(слайд 38)
Учебник О.С. Габриелян 10 класс (профильный уровень): п. 11до стр.75,
Литература.
Горковенко М. Ю. Поурочные разработки по химии к учебным комплектам О. С. Габриеляна и др., 10 (11) класс. М.: "ВЕКО", 2005 г.
Рыбникова З.Д., Рыбников А. В. Органическая химия. 10 класс: Ключевые темы. Конспекты занятий. Контрольные и проверочные работы. - М.: Айрис - пресс, 2003 г.
Ульянова Г. М. Органическая химия. 10 класс: Методическое пособие. - СПб.: "Паритет", 2003 г.
Электронное издание «Виртуальная школа КиМ, уроки химии 10 – 11 классы»
Интернет ресурсы.









